Considéré comme une alternative propre et durable pour le stockage des énergies renouvelables intermittentes, l’hydrogène reste toutefois encore assez peu compétitif au regard des coûts de production qu’il implique. Un manque d’efficacité et de compétitivité auquel les chercheurs de l’Institut de recherche suisse Paul Scherrer (PSI) pourraient avoir trouvé une solution. Selon les résultats d’une étude publiée lundi 17 juillet 2017 dans la revue scientifique Nature Materials, l’utilisation de nanoparticules de perovskite permettrait d’augmenter de manière significative les performances du processus d’électrolyse de l’eau. Explications.
Les limites du stockage d’énergie à l’hydrogène
Parmi les options pour stocker l’énergie solaire ou éolienne, la conversion en hydrogène par électrolyse de l’eau, consiste à “casser” des molécules d’eau en hydrogène et en oxygène, en utilisant le courant produit par un panneau photovoltaïque ou un mât éolien. L’hydrogène propre peut ensuite être stocké dans des réservoirs, puis être reconverti ultérieurement en énergie électrique, au moyen de piles à combustible par exemple. Cela étant et malgré des résultats encourageants ces dernières années, les technologies de production d’hydrogène sont encore trop instables ou trop coûteuses pour constituer une alternative viable techniquement et économiquement. Le catalyseur notamment, élément déterminant qui permet d’accélérer la dissociation des molécules d’eau dans l’électrolyseur (soit la première étape de la production d’hydrogène) est généralement peu efficient et ne permet pas à l’heure actuelle aux technologies de stockage à l’hydrogène d’être véritablement compétitives sur un marché dominé par les batteries.
Lire aussi : L’hydrogène : un joker énergétique encore très discret
Pour y remédier, une équipe de chercheurs de l’Institut suisse Paul Scherrer (PSI) a développé un nouveau matériau susceptible d’améliorer significativement le rapport coût/performance de l’électrolyse. “Aujourd’hui, on trouve deux types d’électrolyseur sur le marché : les uns sont efficaces, mais chers, parce que leur catalyseur contient entre autres des métaux nobles comme l’iridium. Les autres sont meilleur marché, mais moins efficaces. Notre objectif était donc de développer un catalyseur qui soit à la fois efficace et bon marché en se passant de métaux nobles”, explique Emiliana Fabbri, chercheuse au PSI.
Des nanoparticules en perovskite
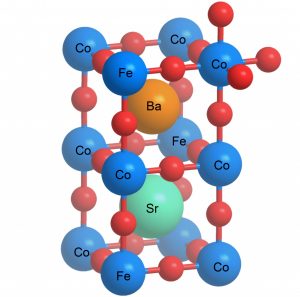
Pour cela, les chercheurs du PSI ont recouru à un matériau complexe composé de baryum, de strontium, de cobalt, de fer et d’oxygène, appelé plus communément titanate de calcium ou perovskite, qu’ils ont produit sous forme de nanoparticules. Si la perovskite est déjà connue et étudiée au profit de nombreux projets de recherche sur la composition des cellules solaires, l’innovation des scientifiques suisses réside avant tout dans la miniaturisation de la matière.
Selon eux, la perovskite ne peut déployer une action efficace que sous la forme de nanoparticules. “Un catalyseur a besoin d’une surface aussi importante que possible au niveau de laquelle de nombreux centres réactifs accélèrent la réaction électrochimique. Or si l’on miniaturise autant que possible les différentes particules du catalyseur, leurs surfaces s’additionnent pour former une surface totale plus importante”, poursuit Emiliana Fabbri.
Des premiers tests surprenants mais concluants
Les chercheurs ont non seulement montré que leurs développements fonctionnaient dans le cadre d’essais en laboratoire, mais aussi qu’ils étaient véritablement utilisables dans la pratique. Testé en collaboration avec un fabricant américain d’électrolyseurs, le dispositif de l’institut PSI a déjà fait preuve d’une efficacité supérieure à celui d’un catalyseur plus traditionnel composé d’oxyde d’iridium. Les analyses des premiers résultats ont bien démontré un comportement relativement instable de la perovskite mais qui s’est avéré au final avantageux dans son rôle de catalyseur.
Lire aussi : Des cellules solaires en perovskite atteignent un rendement record de 21,1 %

En exploitation, la structure à la surface des particules se modifie, et le matériau devient en partie amorphe, ce qui signifie qu’à certains endroits, les atomes ne sont plus agencés de manière régulière. “Ce résultat est inattendu dans la mesure où c’est précisément ce phénomène qui contribue à faire du matériau un meilleur catalyseur. Ces travaux pourraient constituer une base importante pour le développement d’électrolyseurs d’eau de prochaine génération”, conclut le PSI. Pour ne rien gâcher, ce procédé serait également très facile à mettre en œuvre dans le cadre d’une production plus large. Le procédé de fabrication fournit en effet d’importantes quantités de poudre catalytique et devrait donc pouvoir être facilement étendu à l’échelle industrielle.
Crédits photo : Institut Paul Scherrer/Emiliana Fabbri/Mahir Dzambegovic

COMMENTAIRES
N’est-il pas dangereux de se lancer dans un système de stockage reposant sur une ressource naturelle fragile et répartie de manière non uniforme sur notre bonne vielle planète Terre ?
De plus, l’eau la plus « simple » financièrement à électrolyser (eau douce) est encore plus rare car elle ne représente que 2,5 % de l’eau disponible sur le globe. En effet, la désalinisation de l’eau de mer reste onéreuse et diminue donc la rentabilité intrinsèque d’un processus de stockage quel qu’en soit l’échelle.
N’est-ce pas se lancer une nouvelle fois à corps perdu dans une impasse énergétique que de prendre une telle voie sachant la difficulté de certaines populations à avoir accès à l’eau potable ?
Pour appuyer mon propos un article paru sur le site Futura-sciences :
http://www.futura-sciences.com/planete/questions-reponses/eau-y-t-il-eau-douce-monde-805/
Alors, quand bien même aucune des solutions connues aujourd’hui n’est parfaite, ne devrions-nous pas réfléchir à une solution viable pour tous et ne risquant pas de privé l’Humanité d’une ressource dont elle ne peut se passer ?
La perovskite appelée titanate de calcium ? L’article explique que le composé de Fe, Co, Ba, Sr, O… est le catalyseur employé, mais point de Ti… C’est la structure minérale de CaTiO3, orthorhombique, qui est reproduite par ce composé.
Question : Toutes les structures similaires ont la même efficacité ?
Arrive-t-on à comprendre le mécanisme de la catalyse ?
Je suppose que la perovkite est à la cathode, je croyais les nanoparticules sous forme de poudre, comment les éléments de cette poudre sont ils reliés entre eux ? (collés à un substrat ??).
Quelle est la nature de l’anode ? Cu ? Graphite ?
Bravo pour vos progrès !
Bonjour Carol,
Le fer et le cobalt prennent la place du titane, et effectivement, par abus de langage, on parle de “perovkite” ce qui a la structure perovskite. Le CaTiO3 en lui même ne doit pas être efficace pour cette réaction car il n’est pas bon pour l’oxydo-réduction (ses éléments restent au même nombre d’oxydation, contrairement au fer).
Les cellules électrolytiques qui utilisent des poudres les déposent directement sur la membrane de séparation entre la cellule cathodique et la cellule anodique, souvent un polymère de type Nafion.
La cathode, qui fait l’oxydation de l’eau, est souvent en platine.
Pour répondre à Luci: il faut très peu d’eau pour produire suffisamment d’énergie via l’hydrogène et cette eau va être régénérée lors de la combustion de l’hydrogène, donc il n’y a pas de soucis.
Bonne journée !
Damien.
Le système tourne en circuit fermé et ne consomme donc pas d eau.
J’ai lu avec grand intérêt vos articles sur la fabrication d’ hydrogène car je pense un jour acheter une voiture roulant à l’ hydrogène. Bien entendu j’attends que de nouveaux projets ou inventions viennent un jour.
Odéon De vleeschouwer